ГЕННАЯ ТЕРАПИЯ ex vivo
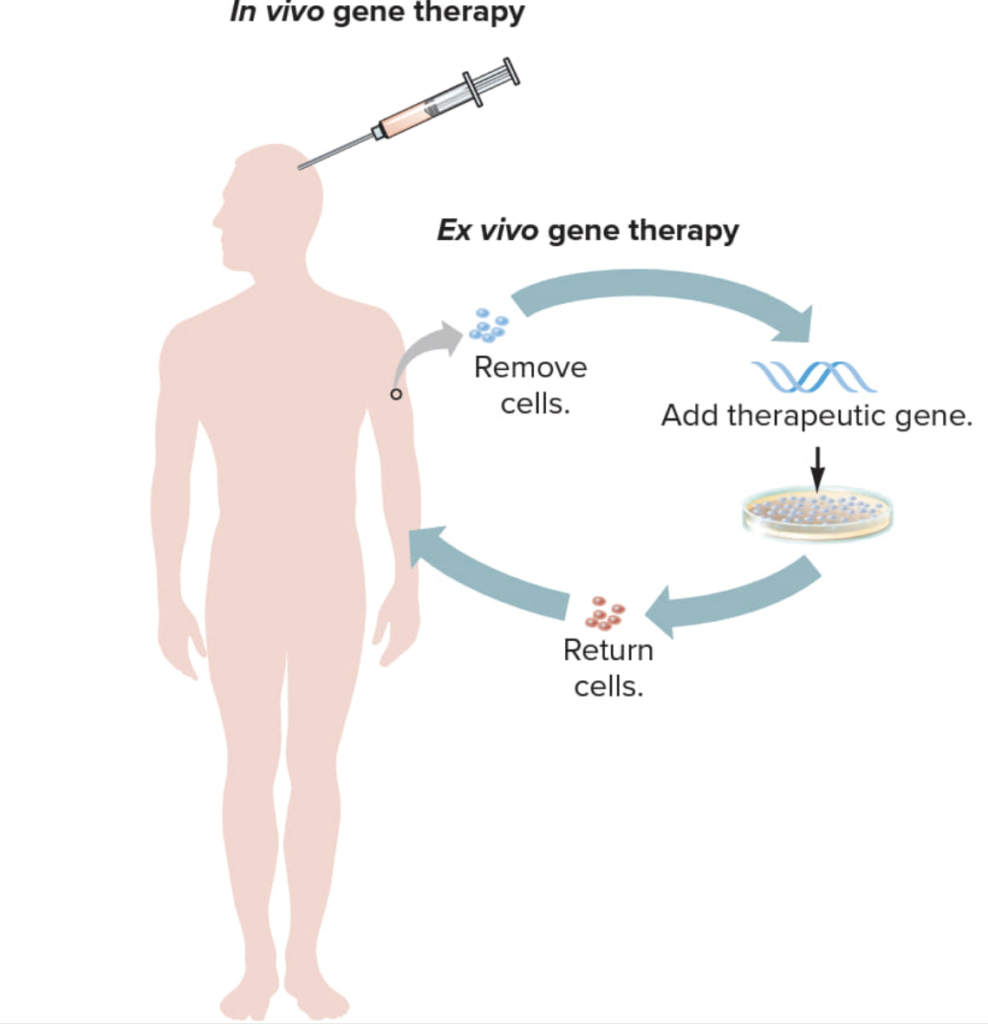
При генной терапии ex vivo («вне тела») клетки меняются вне тела, а затем помещаются в организм, например, через внутривенную инфузию или спинномозговую жидкость. Но мы создали более продвинутую технологию.
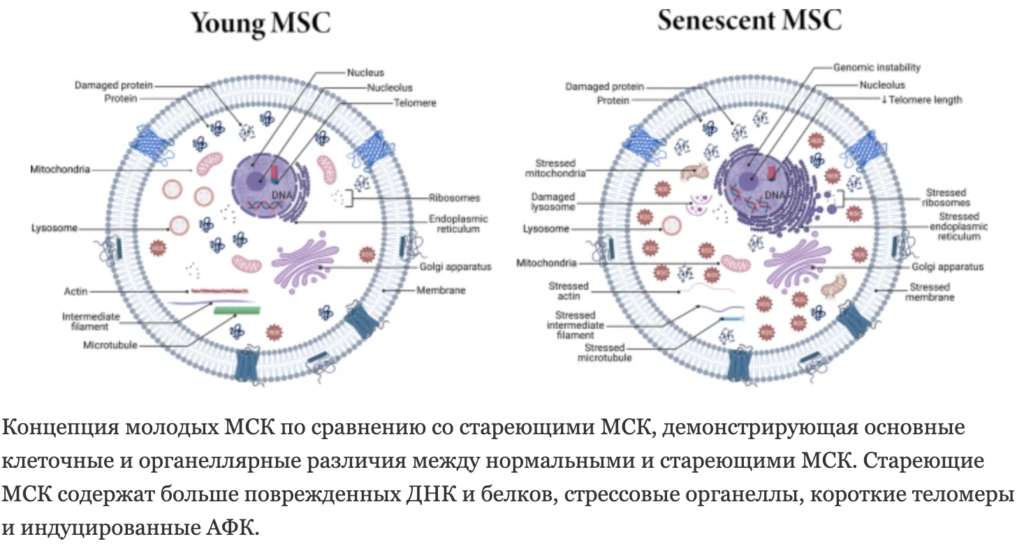
МСК представляют интерес в клинической практике из-за их иммуномодулирующей активности и способности к регенерации тканей. Первым «включателем» механизма старения МСК являются геномные ошибки. Нестабильностью генома, укорочением теломер и эпигенетические изменения.
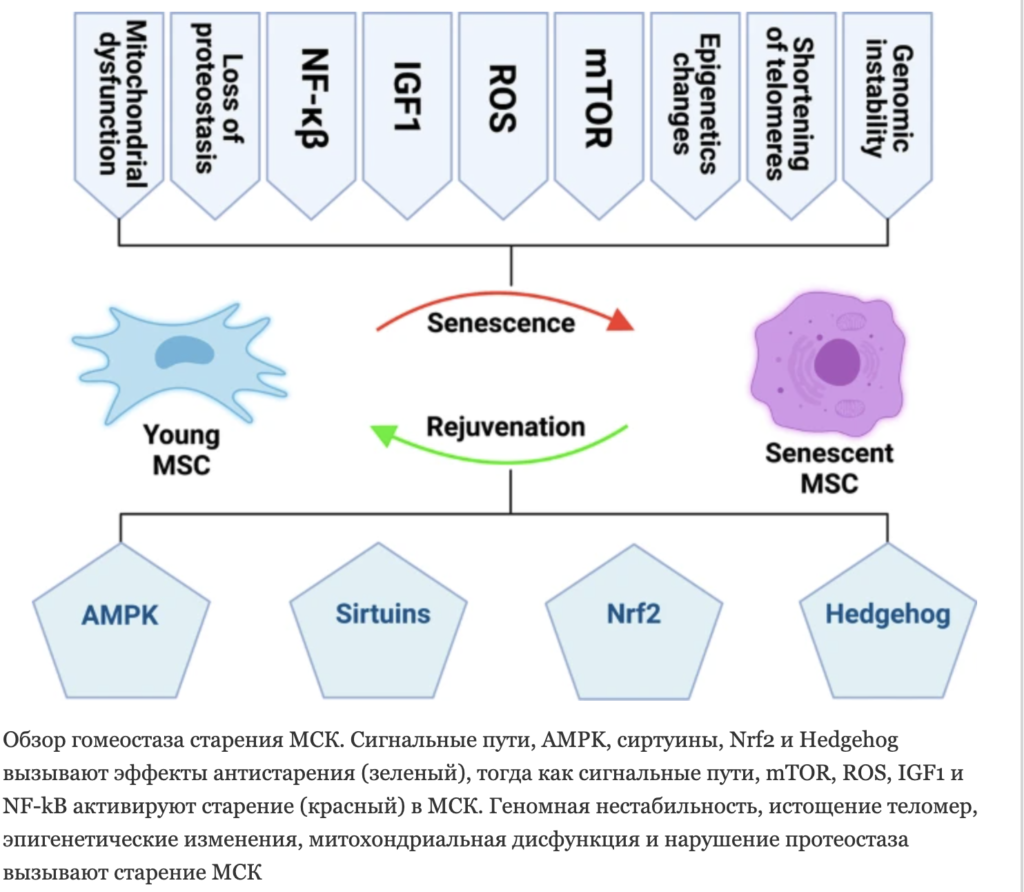
Стареющие МСК характеризуются потерей способности репарации ДНК и антиоксидантной способности, вследствие чего они более восприимчивы к онкогенезу и повреждению ДНК. www.cmbl.biomedcentral.com/articles/10.1186/s11658-022-00366-0.
Новая технология реставрации генома МСК (ex vivo) позволяет вернуть утраченный возрастной потенциал за счет восстановления клеточной поликлональности.
Человеческое старение изменяет пространственную организацию между CD34+ гематопоэтическими клетками и адипоцитами в костном мозге.
Клональный гематопоэз, связанный с возрастом, является главным фактором риска миелоидной злокачественности, а миелоидный перекос – отличительная черта старения.
Усиление прилегания к адипоцитам в микросреде могло повлиять на миелоидный перекос старения ГСПК, что способствует возрастному риску миелоидных злокачественных новообразований.
• Старение увеличивает плотность костного мозга, миелоида и CD34+ HSPC в костном мозге человека;
• Ниша Human CD34+ HSPC ретикулярна, периваскулярна и периадипоцитична в старении;
• Старение увеличивает плотность миелоидных клеток вокруг адипоцитов.
Адипозность увеличивается с возрастом, что коррелирует с повышенной плотностью зреющих миелоидных клеток и CD34+ гематопоэтических стволовых / прогениторских клеток (ГСПК) и повышенной долей ГСПК, прилегающих к адипоцитам. Однако плотность и расстояние до ГСПК и сосудов оставались стабильными. При старении миелоидная плотность клеток увеличивается в гематопоэтических зонах, окружающих адипоциты.
www.cell.com/stem-cell-reports/fulltext/S2213-6711(20)30232-0
В организме здорового человека при рождении имеется 50 000-200 000 ГСК и они в этом количестве постоянно обновляются до 25-30 лет. В раннем возрасте ГСК находятся в вилочковой железе, селезенке, костном мозге.
После 25-30 лет в организме взрослого человека наступает переход исключительно на костномозговое кроветворение. С этого времени новых клеток не образуется. И запас начинает истощаться. Каждая клетка в миллиардах клеток крови одного человека формирует свой клон клеток потомков, которые формируют все клетки иммунитета и клетки циркулирующей крови. Одновременная работа до 1000 клонов ГСК в костном мозге формирует многообразие клеток крови, которое обеспечивает здоровье и долголетие человека.
Одновременная системная работа многих клонов ГСК в крови одного человека и называется поликлональностью. Каждый клон ГСК при проведении геномного анализа имеет свою специфику, хотя все они имеют один геном у них разные экзомы и эпигенетические особенности по которым их легко отличить друг от друга. С возрастом процесс поликлональности меняется. Кроме того, он изменен у здоровых и больных.
Кроветворные стволовые клетки или мультипотентные клетки-предшественники (HSC/MPPs) накапливают в среднем 17 мутаций в год после рождения и теряют 30 пар оснований в год длины теломер. Гематопоэз у здоровых взрослых моложе 65 лет массивно поликлональный, с высоким клональным разнообразием и стабильной популяцией из 20 000–200 000 HSC/MPP, равномерно способствующих продукции крови. Напротив, гемопоэз у лиц старше 75 лет показал резкое снижение клонального разнообразия. У каждого из пожилых субъектов 30–60% гемопоэза приходилось на 12–18 независимых клонов, каждый из которых вносил вклад в 1–34% продукции крови.
Большинство клонов начали свою экспансию до того, как субъекту исполнилось 40 лет, но только 22% имели известные драйверные мутации. Анализ полногеномной селекции показал, что от 1 из 34 до 1 из 12 несинонимичных мутаций были движущими факторами, которые накапливались с постоянной скоростью на протяжении всей жизни и затрагивали больше генов, чем выявлено при раке крови. www.ncbi.nlm.nih.gov/pmc/articles/PMC9177428/
Более того, изменение клональности клеток костного мозга напрямую связано с этиологией возрастных изменений при атеросклерозе. doi.org/10.1101/2022.01.18.476756
Репертуар TCR CD8 + T-клеток остается относительно олигоклональным, и одни и те же доминантные клоны TCR можно наблюдать до и после аТГСК без заметных клинических последствий. Это говорит о том, что эти CD8 + Т-клетки не являются аутоиммунными или неспособны индуцировать активность заболевания после трансплантации. CD4 + Т-клетки характеризуются полным обновлением репертуара TCR, и особенно повышенное разнообразие TCR для регуляторных Т-клеток кажется важным для успешной индукции ремиссии после трансплантации. www.frontiersin.org/articles/10.3389/fimmu.2018.00767/full
Направления коррекции:
- адоптивная иммунотерапия ГСК;
- генная терапия ex vivo;
- старческая система кроветворения может быть восстановлена за счет молодой мобилизованной периферической крови, ГСК. МикроРНК в секретируемых микровезикулах ответственны за улучшение гемопоэтических функций за счет увеличения экспрессии генов, нацеленных на MYC и E2F, и снижения экспрессии p53.
www.aging-us.com/article/203689/text
ПОЧЕМУ ТРАНСПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК НЕДОСТАТОЧНО?
В исследовании использовали трансплантацию, парабиоз, перенос плазмы, упражнения, ограничение калорийности и стареющих мутантных мышей, чтобы понять влияние возрастных системных факторов на HSC и их нишу в костном мозге (BM). Обнаружено, что ни воздействие молодой крови, ни длительное пребывание в молодых нишах после разделения парабионтов, ни прямая гетерохронная трансплантация не оказывали заметного омолаживающего эффекта на старые HSC. Аналогичным образом, упражнения и ограничение калорий не улучшили ни функцию старых HSC, ни старые ниши BM. Напротив, молодые HSC не были затронуты системными условиями, способствующими старению, и на функцию HSC не повлияли мутации, влияющие на старение организма в установленных долгоживущих или прогероидных генетических моделях. Следовательно, кровеносная система, которая несет факторы с омолаживающими или способствующими старению свойствами для многих других тканей, сама по себе невосприимчива к этим факторам.
Вот почему мы рекомендуем сохранять в более молодом возрасте свои собственные ГСК – источник клеток крови, которые можно трансплантировать в пожилом возрасте. www.rupress.org/jem/article-pdf/218/7/e20210223/1416480/jem_20210223.pdf
НОВЫЕ СТРАТЕГИИ
Межклеточный перенос теломер спасает Т-клетки от старения и способствует долгосрочной иммунологической памяти.
www.nature.com/articles/s41556-022-00991-z
РЕМОДЕЛИРОВАНИЕ НИШИ СТВОЛОВЫХ КЛЕТОК
Сохранение стволовых клеток на протяжении всей жизни строго регулируется регуляторными сетями, поддерживаемыми как внутренними, так и внешними механизмами (например, связь с микросредой, паракринная регуляция, опосредованная цитокинами и хемокинами). В свою очередь, уникальные свойства каждого типа тканевых стволовых клеток формируются узкоспециализированными нишами, которые координируют сигналы адгезии, пространственной организации, движения, самообновления или дифференцировки. Следуя аналогичной парадигме, стволовые клетки соединяются со своими нишами для перехода между пассивным и активным состояниями в физиологических и патологических условиях. Действительно, все больше данных свидетельствует о том, что ниши имеют решающее значение для долгосрочного поддержания покоя, поскольку они связывают внутренние механизмы, взаимодействия микроокружения и связь с окружающими клетками вместе, чтобы сбалансировать состояние покоя, пролиферацию и регенерацию стволовых клеток.
Несмотря на свою устойчивость, стволовые клетки со временем накапливают повреждения, что в конечном итоге снижает количество и функции стволовых клеток. Недавние исследования показывают, что покоящиеся стволовые клетки особенно уязвимы для повреждений, связанных со старением.
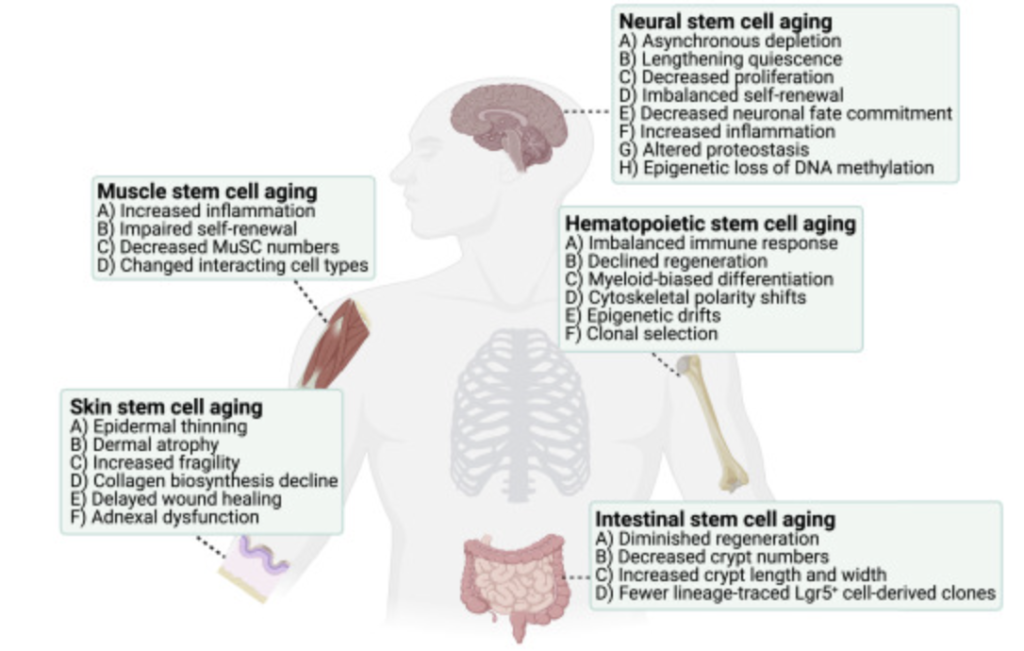
Клональная селекция ГСК также лежит в основе механизмов старения, в сочетании с заметными изменениями в нишах HSC.
www.cell.com/cell-reports/fulltext/S2211-1247(22)01292-X
Мы разработали новый метод терапии ЕХ VIVO прицельно (на основании анализов) восстанавливающего поликлональность. Это принципиально важно потому, что состарившиеся ГСК были устойчивы к системным омолаживающим вмешательствам, передающимся через кровь, таким как трансплантация, парабиоз и перенос плазмы.
www.cell.com/cell-reports/fulltext/S2211-1247(22)01292-X
ТАРГЕТНАЯ ТЕРАПИЯ NK-КЛЕТКАМИ
NK-клетки (или естественные клетки-киллеры) являются важными иммунными клетками, которые имеют решающее значение для врожденного иммунитета. Они обладают противоопухолевыми, противовирусными и иммунорегуляторными функциями. NK-клетки являются патрульными единицами иммунной системы, и они могут быстро реагировать, убивая больные клетки. Наиболее распространенным методом терапии NK-клетками является получение мононуклеарных клеток периферической крови человека и их стимуляция антителами и цитокинами ex vivo, что приводит к активации и пролиферации NK-клеток vitro.
NK-клетки для борьбы со старением путем удаления сенесцентных клеток. Поскольку стареющие клетки естественным образом подвергаются элиминации с помощью NK-клеток, может быть полезно использовать NK-клетки для элиминации персистирующих провоспалительных сенесцентных клеток, особенно по мере их накопления в процессе старения. Широкая цитотоксичность и способность к быстрой гибели делают NK-клетки идеальными для использования в иммунотерапии и для поддержания здорового старения.
ТРАНСПЛАНТАЦИЯ МИТОХОНДРИЙ ОТ МОЛОДОГО ДОНОРА
Митохондриальная аугментационная терапия старения и болезней старения (mitochondria augmentation therapy, MAT). Это клеточная платформа на основе аутологичных гемопоэтических стволовых клеток (HSPC) и их предшественников, в которые вводят митохондрии из другой ткани или от молодого донора. Органеллы получают из мононуклеарных клеток периферической крови с помощью дифференциального центрифугирования и подвергают их криоконсервации. Размороженные митохондрии коинкубируют с CD34+ клетками реципиентов на протяжении 24 часов. Модифицированные клетки суспендируют в 4,5%-ном солевом растворе человеческого сывороточного альбумина, после чего вводятся внутривенно.

